Формирование ранних кругооборотов в сетчатке глаза

|
Первоисточник Эта статья является первичным источником части или всей изложенной в ней информации, содержа первоначальные исследования. |
Формирование первичных нервных сетей во внутреннем сетевидном слое сетчатки — процесс развития нервных сетей в сетчатке — отногенеза (рецепторный уровень) и как процесс развития нервных клеток в ЦНС — филонтогенеза (центральные нейроны серого вещества головного мозга) млекопитающих. [1]
Нейронные сети взрослых особей хорошо организованы в кластеры клеток, расположенных в определенных слоях. Анатомия, физиология и функция многих нейронов сетчатки глаза уже довольно хорошо изучены.
История[править | править код]
Развитие сетчатки требует нескольких шагов.
- Первый шаг должен создать правильную пропорцию 7 типов клеток, которые включает сетчатка. Этот процесс происходит прежде всего через происхождение правильного числа каждых типов клеток. Только клетки нервного узла регулируют их заключительное число участия, которое уменьшает число клеток нервного узла на целых 50 % некоторых разновидностей.
- Второй шаг касается клеток для миграции в правильное местоположение.
- В-третьих, однажды, когда обосновывается правильное число нейронов в их надлежащем местоположении, они начинают формировать синаптические связи с другими относящимися к сетчатке глаза нейронами.
- Наконец, когда эти группы ячеек synaptically соединились, клетки развиваются в кругообороты, которые включают взрослую сетчатку.
Ячейки прародителя в neurepithelium с выравненной поверхностью нервной трубы, позже становится желудочковой зоной в виде оптических пузырьков, оптической чашкой и ранней сетчаткой. Постмитотические ячейки оставляют желудочковую зону, чтобы мигрировать к одному из трех слоев ячейки в сетчатке, остающейся приложенными радиально от одной стороны сетчатки к другой. Это показано в рис. 1, который является от Golgi и лежат окрашенными исследованиями Cajal, которые он сделал в конце прошлого столетия. Нервные ячейки лежат на различных уровнях в сетчатке и когда в правильном положении теряют свои, бросающие якорь, радиальные связи. (Рис. 1). Тогда происходит полярность дистанцирующихся ячеек и дендритов, и аксоны вырастают соответственно. Клетки нервного узла являются первыми, чтобы появиться как распознаваемые нейроны с аксонами, проходящими к оптическому нерву и центральным мозговым структурам (рис. 1, a, b). В то время как ячейки amacrine (рис. 1c), ячейки Muller (рис. 1, d) биполярные, и горизонтальные ячейки формируются в правильном слое. Наконец фоторецепторам остаётся выравнивать главные слои (рис. 1e и f).
Механизмы, которые управляют формированием нервных кругооборотов в течение развития традиционно были разделены на независимые от деятельности и зависимые в своей деятельности. В этом представлении, ранней организацией кругооборотов, а именно, фенотипом, местоположением и ранними связями нейронов, управляют деятельностью независимые механизмы, например, генетический профиль ячейки. Нервная деятельность действует независимо от этих генетических реплик, чтобы очистить первоначально сырые связи в детальные кругообороты, которые характеризовали взрослую нервную систему. Так как много стадий относятся к развитию сетчатки глаза, вызванная светом в их нервной деятельности, то они, как думают, являются частью генетического профиля ячейки. Однако, недавнее свидетельство предлагает, чтобы экологические реплики, установленные химической и электрической деятельностью в пределах ячейки влияли на самые ранние стадии развития.
Что если сетчатка не способна ответить на свет, что является источником этой нервной деятельности? Недавние эксперименты в широком разнообразии позвоночных разновидностей демонстрировали, что «Рано» синаптические кругообороты в незрелых сетчатках могут привести и к химической и к электрической передаче сигналов в развивающихся нейронах. Эта область обеспечит обзор источников этой непосредственной активации ячеек и возможной роли этих игр деятельности в развитии сетчатки.
Раннее развитие медиаторов и сетчатки глаза[править | править код]
Есть теперь хорошее свидетельство, когда медиаторы (нервные клетки посредники, передающие сигналы от одной нервной клетки к другой) могут быть найдены в самых ранних стадиях развития в сетчатке глаза, и эти медиаторы могут функционировать в отсутствии традиционных синапсов (Redburn и Rowe-Rendleman, 1996). Например, маркеры холинергических нейронов (, типа антител к холиновой трансферазе ацетила и ацетилхолину esterase) могут быть соблюдены в neuroblastic слое уже на третий эмбриональный день в цыпленке и P0 в хорьке и мыши (Лесоруб и др., 1996; Bansal и Лесоруб, неопубликованные наблюдения), в период, связанный с развитием, в течение которого производятся amacrine ячейки. Эти ячейки по-видимому starburst amacrine ячейки — единственный источник ацетилхолина во взрослой сетчатке.

Рисунки (см.рис.2) вид поперечных частных представлений сетчатки кролика в различных возрастах. Ячейки покрасили красным, что дало увеличения внутриклеточной концентрации кальция, как оценено отображением кальция, к коротким заявлениям величиной 100‒200 мкм никотина. В эмбриональной сетчатке, дифференцируя ячейки, которые формируют примитивный слой ячейки нервного узла (GCL), были расположены в vitreal половине (V) из сетчатки; scleral половина (S) включает желудочковую зону (VZ). В P1, ячейки в VZ все еще гомогенны в форме и размере. В P5, тонкий innerplexiform слой отделил внутреннее (INL) и внешние ядерные слои (ONL). Предполагаемые amacrine (a) и биполярные ячейки (b) обозначены. (От Wong, 1995.)
Контролируя внутриклеточные концентрации кальция, используя отображение флюоресценции, Wong (1995) показал, что в течение этих начальных стадий развития сетчатке глаза участвует muscarinic рецептор ацетилхолина (mAChR), и участники состязания вызывают существенные увеличения внутриклеточного кальция многих ячеек в neuroblastic слое (см. иллюстрацию 2, выше). М. AChRs — cGMP gated каналы приводят к увеличениям внутриклеточного кальция вызывая выпуск кальция от внутренних складов в противоположность притоку лиганда — или активизированных напряжением каналы. После того, как ячейки были постмитотическими и начали мигрировать из желудочковой зоны, этот живой отклик mAChR участников состязания был уменьшен. Amacrine клетки и ячейки нервного узла все еще имели ответы на присутствие холинергических участников состязания, но они были установлены через nicotinic рецепторы, поскольку они находятся во взрослом виде. Следовательно, кажется возможным, что даже прежде, чем холинергические нейроны оставили желудочковую зону, и прежде, чем эти нейроны сформировали синаптические связи, они смогли вызывать передачу сигналов, которая является важной для ранних фаз neurogenesis и также перемещение ячейки.
Как обсуждено ниже, активация nAChRs также жизненно важна для того, чтобы произвести непосредственную деятельность в IPL (в периферийной сетчатке тело клетки часто простирается в системе импульсного пространства IPL при внеклеточной регистрации от ячеек P) (см. Рис.11) в более поздних стадиях развития сетчатки глаза.
GABA выражен в большем количестве ячеек в процессе развития нежели, чем в течение взрослой жизни. Иллюстрация 3 показывает число amacrine клеток, которые являются immunoreactive к GABA между E38 и P16 в развивающейся сетчатке хорька по сравнению со взрослой сетчаткой хорька. Это изобилие положительных нейронов GABA предлагает, что как ACh, GABA может играть переходную роль в формировании кругооборота (для обзора, см. Sandell, 1998). Например, GABA, как думают, играет роль в synaptogenesis между колбочкми и горизонтальными ячейками заранее в послеродовом развитии OPL в сетчатке кролика (Messersmith и Redburn, 1993).

Образцы рис. 3 иммунореактивности GABA в развивающейся сетчатке хорька. Бруски масштаба = 25 мкм. От Karne и другие, 1997.
GABA имеет особенно высокое и переходное выражение в слое ячейки нервного узла в течение первых нескольких послеродовых дней кролика. Кроме того, маркеры для ферментов, вовлеченных в синтез GABA могут быть найдены с обеих сторон IPL заранее в развитии сетчатки хорька как показано в фигуре 3 (Karne и др., 1997). Так, подобно к роли, которую GABA может играть в развитии OPL, роль может быть в формировании кругооборотов в IPL.
Сетчатка и электромагнитные волны[править | править код]
Первый синаптический узел (synaptically) соединил кругообороты, которые появляются в развитии, в которых IPL являются синаптическими узлами между amacrine и ячейками нервного узла (Greiner и Weidman, 1981; Karne и др., 1997). До созревания фоторецептора и открытия глаза сетчатки глаза клетки нервного узла, нейроны образуют сетчатку, периодически запускающую взрывы потенциалов действия. Эта непосредственная ритмичная деятельность была сначала измерена в эмбриональных щенках крысы. Эта деятельность, как находили, была высоко коррелирована среди соседних ячеек нервного узла (Galli и Maffei, 1988). Они при внеклеточной регистрации, используя множество мультиэлектродов (Meister и др., 1991) и отображая переходные процессы кальция, связанные со взрывами потенциалов действия (Лесоруб и др., 1997; Wong и др., 1995), показали, что эти непосредственные взрывы размножаются от одной ячейки до следующей в манере подобной волне. Недавние эксперименты демонстрируют, что блокада непосредственной деятельности, относящейся к сетчатке глаза, разрушает нормальный образец аксонов ячейки нервного узла в ее первичном виде, и боковой geniculate ядра таламуса. (Penn и другие, 1998) указывают, что непосредственная их деятельность в сетчатке играет критическую роль в нормальном развитии взрослой визуальной системы.

Рис. 4 Time развитие непосредственно относящееся к сетчатке глаза волны с размерами отображения флюоресценции в сетчатке хорька P2, помеченной fura-2AM. Каждая структура — последовательные 0.5 вторых интервала от кино в реальном времени. Fura-2 уменьшения флюоресценции, связанные с увеличениями внутриклеточной концентрации кальция. Полную область сетчатки, покрытой электромагнитной волной называют областью. (Лесоруб и другие, 1996). (117 КБ jpeg изображение)

Рис.5. Пространственно-временные свойства, относящихся к сетчатке глаза волн. Изображена последовательность областей, которые были измерены в единственной области отображения представления (прочитанный от слева направо, главный ряд сначала). Красная область в каждой структуре соответствует новой волне в области. Перекрытые области происходит больше, чем величина одной волны, показывают в черном. Первую волну в последовательности показывают в синем. Вся последовательность соответствует 90 секундам регистрации, и полная область представления — 1.2 x 1.4 мм. Границы распространения волн определены частично вызванными волной невосприимчивыми областями, которые длятся в течение 40‒50 секунд. Участки инициирования волны так же как местоположения границ не повторяются. (Лесоруб и другие, 1997). (195 КБ jpeg изображение).
Волны сетчатки глаза — чрезвычайно здравое явление, наблюдаемое в большом разнообразии позвоночных разновидностей, включая цыпленка, черепаху, мышь, кролика, крысу, хорька и кота (Wong, 1999). Хотя периодичность волны и скорость во всех разновидностях сопоставимы, схема, лежащая в основе распространения, может быть существенно отличной. Волны сначала замечены в течение времени, когда нейроны, проживающие во внутренней сетчатке начинают формировать кругообороты, в то время как внешние нейроны сетчатки глаза не образовали синаптические связи; фоторецепторы еще не функциональны (Greiner и Weidman, 1981; Mey и Thanos, 1992). В этой стадии развития ячейки нервного узла мигрировали в слой клетки нервного узла, и их аксоны достигли их первичных целей — бокового geniculate ядра у млекопитающих, и тестов (tectum) в цыпленке.
Химическая синаптическая передача[править | править код]
В послеродовом хорьке и сетчатках мышей, химическая синаптическая передача — предпосылка для распространения волны, как обозначено несколькими экспериментальными результатами. Во первых, одновременная целая регистрация зажима напряжения ячейки от ячеек нервного узла демонстрирует, что увеличения [Ca2 +] коррелировасись поперек ячеек, и проводятся составными синаптическими входами (иллюстрация 5, Лесоруб и др., 1996) (рис. 5 и 6). Во вторых, составные постсинаптические потоки, измеренные от ячеек нервного узла блокированы заявлением ванны Cd2 +, блокатор активизированных напряжением каналов кальция, включая связанные с выпуском передатчика (Лесоруб и др., 1996). В-третьих, периодический [Ca2 +] способствует увеличению потенциала действия, и приводит к соглашению постсинаптических потоков, связанных с волнами, которые все могут быть блокированы разнообразием nAChRs антагонистов (Лесоруб и др., 1996; Penn и др., 1994). Отметьте, во взрослой сетчатке, действия ацетилхолина выступают как модулятор увольнения ячейки нервного узла, в то время как глутамат — первичный возбудительный передатчик. Однако, в самых ранних возрастах glutamatergic блокаторы не затрагивают поколение волны (Wong, 1995).
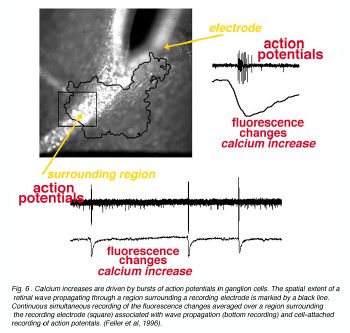
Рис.6. Увеличения кальция ведут ко взрывам потенциалов действия в ячейках нервного узла. Пространственная степень, относящейся к сетчатке глаза волны, размножающейся через область, окружающую электрод регистрации и отмечена черным пятном. Непрерывная одновременная регистрация изменений флюоресценции, усредненных по области, окружающей электрод регистрации (квадрат) связалась с распространением волны (регистрация основания) и приложенная ячейкой регистрация действия potentals. . (Лесоруб и другие, 1996).
Ацетилхолин вовлечен только в инициировании волн. А может быть вовлечен в распространение деятельности от одной области сетчатки к другой? Чтобы вернуться к этому вопросу, было большое количество ячеек в пределах слоя ячейки нервного узла было деполяризовано непосредственно изгнанием давления калия от пипетки (иллюстрация 7) (Лесоруб и др., 1996). Такая крупномасштабная деполяризация надежно начинает действия волны. Однако, в присутствии nicotinic AChR антагонисты, изгнание давления калия все еще вызывает большую деполяризацию ячеек вокруг пипетки, и волны не могут быть произведены. Эти эксперименты указывают, что холинергическая синаптическая передача требуется для распространения деятельности далеко от местной области деполяризации.

Рис.7 .Распространение волны требует холинергической передачи. Короткое центральное заявление ACSF, содержащего высокие концентрации калия деполяризует местную группу ячеек и надежно начинает волны в ACSF. В присутствии nAChR антагониста, d-tubocurarine, ячейки все еще деполяризуются ячейками, но деятельность не может размножиться далеко от местной области деполяризации.
Как упомянуто выше, единственный источник ACh в сетчатке — подкласс amacrine ячеек, названных starburst amacrine ячейки. Иммуногистохимические окраски для холина acetyltransferase (ЧАТ) показывают, что это население ячеек существует рано в развивающейся сетчатке хорька. Zhou (1998) одновременно зарегистрированный от кролика starburst amacrine и ячеек нервного узла и найденный, что starburst ячейки подвергаются непосредственным деполяризациям, которые коррелированы с деполяризациями соседних ячеек нервного узла (См. рис. 8). Эти эксперименты также показывают, что, как ячейки нервного узла, starburst amacrine ячейки взволнованы через синаптический вход в течение волн. Это совместимо с недавними полученными данными от Stellwagen и др. (1999), что составные постсинаптические потоки, связанные с волнами не уменьшены в присутствии tetrodotoxin. Хотя starburst ячейки имеют способность запустить потенциалы действия рано в развитие (Zhou и Охотно, 1996), они не достигают порога потенциала действия в течение волн (Zhou, 1998), указывая, что они выпускают ACh в действии независимая от потенциала, градуируемая мода, особенность взрослых amacrine ячеек. Хотя источник синаптического входа к starburst amacrine ячейки в течение волн неизвестен, эти результаты указывают, что сложная сеть amacrine и ячеек нервного узла, связанных через возбудительные химические синапсы, добивается к относящимся к сетчатке глаза волн.

Рис.8. Волна ведет сеть холинергических amacrine ячеек. Ячейки, которые являются immunopositive для холиновой трансферазы ацетила, добавлены на псевдоцветном изображении относящихся к сетчатке глаза волн. Брусок масштаба — 100 микронов.
Синаптическая схема, которая ведет в сетчатке глаза изменения волн постнатально. Хотя холинергическое neurotransmission требуется, и GABA вносит свой вклад в деполяризацию ячеек в течение относящихся к сетчатке глаза волн рано в развитии в хорьке, недавние исследования в старших хорьках указывают, что волны нечувствительны к холинергическим антагонистам и могут быть блокированы глутаматными антагонистами рецептора (Wong, 1999). Этот выключатель в необходимом передатчике происходит в возрасте, что биполярные ячейки делают их начальные синаптические связи с ячейками нервного узла и когда обычные синапсы между amacrine и ячейками нервного узла, которыми становятся морфологически назревают и многочисленный. Это приводит к гипотезе, что возможно волны установлены медиаторами только тогда, когда синапсы сначала формируются (рис. 9).
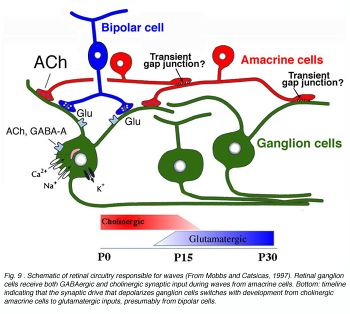
Схемное решение схемы сетчатки глаза ответственно за волны (От Mobbs и Catsicas, 1997). Клетки сетчатке глаза нервного узла получают и GABAergic и холинергический синаптический вход в течение волн от amacrine ячеек. Основание: график времени указывает, что синаптический двигатель, который деполяризует выключатели ячеек нервного узла с развитием от холинергических amacrine ячеек до входов glutamatergic, по-видимому, от биполярных ячеек. (117 КБ jpeg изображение)
GABA имеет modulatory роль в относящихся к сетчатке глаза волнах. Отображение непосредственных увеличений Ca2 + связанный с волнами показало, что антагонисты рецептора GABA-A могут драматично изменить количество вызванной волной деполяризации (Fischer и др., 1998). GABA — первичный передатчик большинства amacrine ячеек в сетчатке, и, в самых молодых изученных возрастах, это обеспечивает возбудительный вход для ячеек нервного узла (Fischer и др., 1998). В отличие от ACh, однако, GABA не влияет на периодичность волны, так как блокаторы GABA не изменяют ни одну частоту холинергических заграждений, которые связаны с волнами, измеренными в ячейках нервного узла (Лесоруб и др., 1996), или на другие свойства распространения волны в возрастах меньше, чем P10 (Fischer и др., 1998; Stellwagen и др., 1998).
Волны сохраняются после того, как GABA становится запрещающим (Fischer и др., 1998). Однако, эти изменения в схеме, добивающейся волны, с развитием приводят к изменениям в частоте событий, происходящих в различных подмножествах ячеек нервного узла (см. ниже).
Соединения промежутка[править | править код]
Промежуток junctional сцепление между ячейками нервного узла и между нервным узлом и amacrine ячейками в послеродовых сетчатках хорька был оценен neurobiotin экспериментами инъекции (Penn и др., 1994). Как может быть замечено в фигуре 10, у хорька, как у кролика, кота и примата, признаки показа сетчаток сцепления краски между ячейками того же самого типа (homotypic сцепление) и различных типов (heterotypic сцепление) при введении neurobiotin в единственную клетку. Это сцепление краски особенно сильно между большими поселениями того же самого типа amacrine ячейки, хотя, насколько мы знаем в настоящее время, это не включает взрослое состояние клетки, содержащей ацетилхолин (Vaney, 1994) (Рис. 10).

Рис.10. Промежуток junctional сцепление существует между некоторыми подтипами клеток нервного узла и между нервным узлом и amacrine клетками в ранних стадиях хорька в развитии сетчатки глаза (Penn и др., 1994).
Соединения промежутка, кажется, вовлечены в поколение волны в сетчатке цыпленка. Во всех возрастах, агенты, которые, как известно, запрещают передачу сигнала через соединения промежутка, могут значительно запретить волны (Catsicas и др., 1998; Wong и др., 1998). Octanol, которую запрещает в сетчатке цыпленка E8, ограничивает сцепление трассирующего снаряда между ячейками нервного узла и amacrines, но не сцепление ячейки нервного узла нервным узлом, указывая, что поколение волны вовлекает ячейки кроме ячеек нервного узла. Медиаторы также затрагивают распространение волны и, как в хорьке, играет роль modulatory различных изменений систем передатчика с возрастом. В самых ранних возрастах, изученных (E8-E11), не блокированы уменьшения частоты волны в присутствии антагониста ACh и возрастания состязаний участникаACh, но только волн. Волны не затронуты GABA-A и глутаматными антагонистами рецептора (Catsicas и др., 1998). Напротив, в старших возрастах (кроме E11), волны блокированы полностью комбинацией глутаматных антагонистов, увеличением частоты волн в присутствии антагониста GABA-A, но не затронуты антагонистами ACh (Wong и др., 1998).
Электрическая передача играет ли роль в производстве волн сетчатки глаза у млекопитающих в дополнение к активной химической (холинергической) передаче? Передача соединения промежутка может фактически быть под влиянием ACh, который показался в развивающейся коре головного мозга (Roerig и Katz, 1998). Иллюстрация 10 показывает государство сцепления краски между ячейками нервного узла и amacrine ячейками в послеродовых сетчатках хорька. Думается, что соединения промежутка между ячейками нервного узла вряд ли будут основанием распространения волны. Сцепление трассирующего снаряда ограничено ячейкам нервного узла того же самого подтипа, и главного класса ячеек нервного узла, бета ячейки в хорьках (аналогичный ячейкам X у кота), не приводить никакого доказательства сцепления (см. рис. 10). Кроме того, в развитии, сцепление ячейки нервного узла первоначально слабо, затем становится более сильным с возрастом. Обратные корреляции происходят с волнами, потому что они становятся более слабыми с возрастом (Wong и др., 1993). Одна идея — то, что сцепление соединения промежутка между amacrine ячейками (возможно холинергические amacrine ячейки) является переходной ранней фазой нанятой передачи прежде, чем химические синапсы полностью зрелы. Однако, сцепление трассирующего снаряда между amacrine ячейками в самых ранних возрастах должно все же быть определено. Кроме того, это могло одинаково хорошо постулироваться, что первые переходные соединения промежутка между нервным узлом и amacrine ячейками могли обеспечить возбуждение от слоя ячейки нервного узла назад к amacrine слою ячейки.
Недавние эксперименты демонстрировали что агенты, известные, чтобы влиять на сцепление через соединения промежутка модуляцией внутриклеточных уровней лагеря (Hampson и др., 1992; Заводы и Massey, 1995), имеют драматические эффекты на распространение волн (Stellwagen, 1998). Как в развивающейся сетчатке цыпленка (Catsicas и др., 1998), forskolin, допамин и аденозиновые участники состязания все приводят к большим, более быстрым и более частым волнам в относящихся к сетчаткам млекопитающих. В целом, кажется, что соединения промежутка играют более важную роль в поколении волны в более ранних стадиях, прежде, когда химические синапсы начали формироваться, чем в более поздних стадиях развития в сетчатке млекопитающих.
Роль деятельности сетчатки в формировании зрительной системы[править | править код]
| Фоторецепторные клетки, нейроны и слои сетчатки глаза
(Свет снизу) | |
|---|---|
 Рис. Р.[2]
Стрелка и пунткирна линия — внешняя пограничная мембрана | |
Спонтанная активность в развивающейся сетчатке происходит в то время, когда функциональные схемы формирования в сетчатке и прогнозы от сетчатки проходят уточнение в их целевых регионах в мозге. Какую роль в сетчатке выполняют волны, которые должны играть в скульптуре цепей, которые обеспечивают видение?
Схемы ВКЛ / ВЫКЛ в сетчатке глаза[править | править код]
Две суб-схемы, которые были хорошо изучены во взрослой сетчатке являются пути ВКЛ(ON) и ВЫКЛ(OFF). Классы биполярных клеток Bi (cм. рис.Р), которые передают ответы с наступлением света (по отзывам) отличаются от тех, которые передают ответы при прекращении света (ответы OFF). Эти схемы включения и выключения это дендриты клеток нервного узла, это процессы амакринных клеток A и входов биполярных клеток, которые физически отделены друг от друга в так называемые слои и выключения во внутреннем слое сетчатки глаза IPL. Формирование этих схем включения и выключения предполагает созревание дендритных типов ганглиозных клеток ipRGC G.
Дендриты большинства ганглиозных клеток сетчатки разветвляются (arborize) (разветвления нервного волокна) диффузно во внутреннем слое сетчатки глаза IPL до ограничения их дендритов в отдельную пластинку (Bodnarenko др, 1999;. Бансал др, 2000;. Sernagor др, 2001;. Сюй и Тянь, 2004; Кумбс и др ., 2007; Ким и др, 2010) (рис 11)... Некоторые исследования показали, что это сегрегация ганглиозных клеток дендритов в слои ВКЛ и ВЫКЛ включает активность биполярных клеток. Прежде всего, это разделение предотвращается путем применения АПБ (варианты работы клеток), чтобы гиперполяризации НА(ON) биполярных клеток происходили в период действия глутаматэргических волн сетчатки (фиг.12). (Bodnarenko и Chalupa, 1993; Bodnarenko и др, 1995.). Во-вторых, мыши, лишенные рецептора CD3zeta MHCI и, таким образом, отображают измененные глутаматергические сетчатки волны, которые имеют ганглиозные клетки с пониженной подвижностью дендритных и более диффузных дендритов в пределах IPL (Xu и соавт., 2010) (рис. 11). Однако, не все манипуляции спонтанной деятельности сетчатки в процессе развития изменяют дендритную стратификацию. Предотвращение синаптического высвобождения глутамата от ON биполярных клеток, выразив при помощи столбняка токсина, не препятствует расслоению ганглиозных клеток дендритов, но это позволяет уменьшить образование синапсов на ON биполярных клеток (Kerschensteiner др., 2009).
Имеет ли влияние холинергических волн в этом процессе стратификация (расслоение) клетки ганглия? Некоторые исследования показывают, что есть. Во-первых, блокируя nAChRs в период холинергических волн, понижается моторика filipodia дендритов ганглиозных клеток (Wong и Вонг, 2001). Демонстрируя при этом, что холинергические волны могут приводить структурные изменения в дендритах. Во-вторых, исследования черепахи показывают, что блокирование холинергическиой волны в нАХР антагонистов снижает восприимчивость размеров полей (Sernagor и Grzywacz, 1996). Наконец, мыши, лишенные beta2 субъединицы нАХР демонстрируют задержку, но не отсутствие мелкой стратификации ганглиозных клеток дендритов (Bansal др., 2000). Эти данные показывают, что холинергические волны оказывают влияние на рост дендритов ганглиозных клеток, но они не основной фактор, который диктует свои окончательные организации.
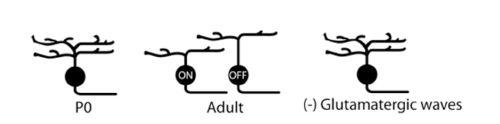
Рисунок 11. Вид сетчатки волны при изменении, когда она уточненяет некоторые места сетчатки дендритов ганглиозных клеток.
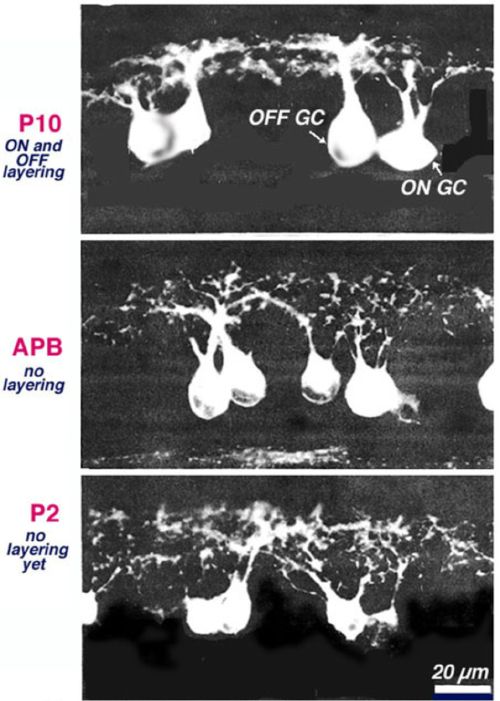
Рисунок 12. Активность зависит при поддержке ганглиозных клеток дендритных расслоений в развивающейся сетчатке кошки (Bodnarenko и Халупой, 1993).
Передача сигнала ON(ВКЛ) OFF(ВЫКЛ) во взрослой сетчатке[править | править код]
Для примера подкругооборотов, которые были хорошо охарактеризованы во взрослой сетчатке, - НА и ОТ троп. Различные классы биполярных клеток передают ответы на начало света (НА ответах) через отличный кругооборот от клеток, которые передают прекращение передачи света (ОТ ответов). Диаграмму этой известной схемы и разделения рабочей силы в сетчатке кота показывают ниже (Нельсон и др., 1978).

Дендриты ячейки нервного узла, amacrine процессы клетки и входы биполярной ячейки для этих двух кругооборотов являются физически отделёнными друг от друга в том, что называют НА и ОТ слоев IPL (иллюстрация 13).

На Фиг. 14. Наслоение ON и OFF биполярных, ганглиозных клеток и их аксонов у кошки во внутреннем сетчатом слое (IPL). OFF ганглиозных клеток (αGC и βGC) дендриты и OFF колбочек и биполярных клеток аксонов (OFF cb) стратифицированы (расслоение) в sublamina в слое IPL. ВКЛ(ON) аксоны биполярных клеток (ON cb) и ганглиозных клеток дендритов стратифицированы в слое sublamina b IPL. Эти параллельные включения и выключения путей передачи биосигналов колбочки, которые происходят с биполярными-клетками в дендритных контактах с колбочками. Иллюстрации постоянно изменяются от Nelson et al, 1978 (100).[5]
Работа колбочек и палочек в системе ON, OFF[править | править код]
Палочки в связи с биполярными клетками являются уникальными. Эти клетки легко идентифицируются как у млекопитающих так у рыб. В большинстве млекопитающих аксоны колбочек стратификацируют контакты с биполярными клетками. Аксон опускается вглубь на sublamina b IPL, где он arborizes в луковичные терминалы рядом с ганглиозными клетками. Палочки млекопитающих имеют связи с биполярными клетками по типу с использованием метаботропных APB-чувствительных рецепторов глутамата. В рыбе сетчатки, палочка через биполярные клетки также связывается с колбочками, но не напрямую. Пять таких типов находятся в goldfish сетчатки, в том числе несколько типов ветвления аксона терминалов в sublamina bи, скорее всего, когда выключены типы ветвления аксона терминалов в sublamina. Таким образом при работе колбочек и палочек идёт ВКЛ и ВЫКЛ прохождения биосигналов в период дневного освещения и сумеречного.

Выводы[править | править код]
Проведенные исследования рождения, развития и формирования взрослых нейронов — нервных клеток сетчатки во всех слоях показывает, что в зависимости от окружающей среды, в целях выживаемости зрительная система разных видов обитателей имеет свои особенности и общие черты. Не возможно объективно изучить процесс восприятия света и цвета не рассматривая живые клетки на любых уровнях. Например, цветовосприятие возможно понять исследуя живую сетчатку и связи всех клеток всех слоёв сетчатки.
См. также[править | править код]
Примечания[править | править код]
- ↑ а б в г д е ё ж з и й к Kevin J. Ford and Marla Feller. "Retinal Neurogenesis: Early stages in the development of neurons and pathways". Webvision. Retrieved 27 июня 2014. Check date values in:
|accessdate=(help) - ↑ http://commons.wikimedia.org/wiki/User:%D0%AE%D0%BA%D0%B0%D1%82%D0%B0%D0%BD#mediaviewer/File:Retina_layers.svg
- ↑ http://webvision.med.utah.edu/DEV2.html
- ↑ http://webvision.med.utah.edu/book/part-v-phototransduction-in-rods-and-cones/bipolar-cell-pathways-in-the-vertebrate-retina/
- ↑ http://webvision.med.utah.edu/book/part-v-phototransduction-in-rods-and-cones/bipolar-cell-pathways-in-the-vertebrate-retina/
- ↑ http://webvision.med.utah.edu/book/part-v-phototransduction-in-rods-and-cones/bipolar-cell-pathways-in-the-vertebrate-retina/
- перенаправление шаблон:цвета радуги
| Цвета и оттенки | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 |
|  | |||||||||||||||||||||||||||||||||||
| ∘ ∘ ∘ | |||||||||||||||||||||||||||||||||||||